
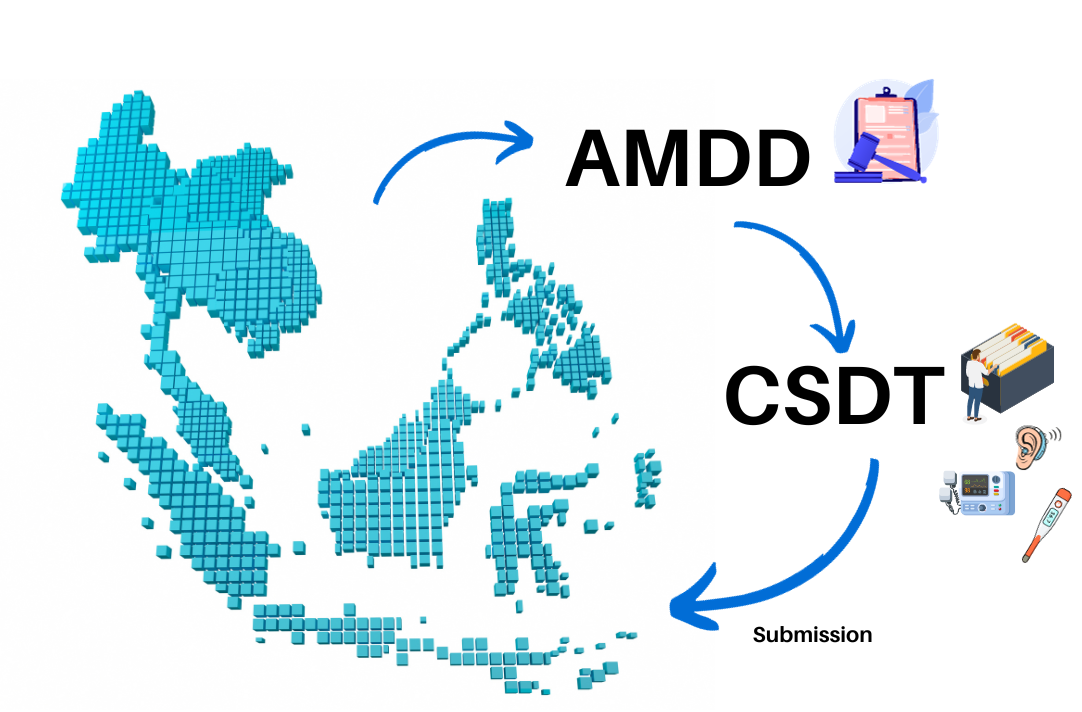
AMDD/ CSDT File
AMDD คือ กฎหมายว่าด้วยเรื่องเครืองมือแพทย์ของอาเซียน AMDD มาพร้อมกับ CSDT หรือ รูปแบบแฟ้มเอกสารที่ต้องจัดทำสำหรับผลิตภัณฑ์เครื่องมือแพทย์ที่ต้องการผลิตและจัดจำหน่ายในอาเซียน
AMDD -ASEAN Medical Device Directive :
กฎหมาย กฎระเบียบข้อบังคับ จัดทำโดย Association of Southeast Asian Nations (ASEAN) เชื่อมโยงกับหน่วยงานกำกับดูแลด้านเครื่องมือแพทย์ของแต่ละประเทศที่เป็นสมาชิก มีเป้าหมายเพื่อให้มั่นใจในความปลอดภัยและประสิทธิภาพของผลิตภัณฑ์เครื่องมือแพทย์ที่จะเข้าตลาดและใช้กับผู้ป่วยในภูมิภาคนี้
Key aspects of AMDD คือข้อมูลและรายละเอียดที่ผลิตภัณฑ์ต้องปฏิบัติตาม EP- Essential Principles อย่างครบถ้วนทั้งด้านความปลอดภัยและประสิทธิภาพ (Safety and Performance), การบ่งชี้หรือระบุระดับความเสี่ยง (Risk Classification categories) , การขึ้นทะเบียนผลิตภัณฑ์และการแสดงวิธีรับรองผลิตภัณฑ์ (สำหรับประเทศไทย คือ การอนุญาต การแจ้งรายละเอียด และการจดแจ้ง )
CSDT -Common Submission Dossier Template :
CSDT คือ รูปแบบเอกสารที่ต้องจัดทำและยื่นเพื่อแสดงความสอดคล้องหรือรับรองผลิตภัณฑ์ คมพ. CSDT file เป็นรูปธรรมหนึ่งที่กฎหมาย AMDD กำหนด (Annex 4 :ASEAN Common Submission Dossier Template) เพื่อยื่นขอตรวจสอบและรับรองผลิตภัณฑ์ในประเทศอาเซียน
ประโยชน์ในการจัดทำ CSDT
- รูปแบบ CSDT ช่วยเพิ่มความคล่องตัวให้กับกระบวนการลงทะเบียนโดยจัดรูปแบบที่สอดคล้องกันในการนำเสนอรายละเอียด ข้อมูลทางเทคนิค ของเครื่องมือแพทย์ โดยครอบคลุมทั้งทางด้านประสิทธิภาพ และความปลอดภัย
- CSDT ลดความซับซ้อนในการจัดทำข้อมูลจากผู้ผลิต
- ส่วนหนึ่งในการจัดทำ CSDT จะทำให้เจ้าของผลิตภัณฑ์ได้ทบทวนข้อมูลของผลิตภัณฑ์อย่างละเอียด เป็นส่วนช่วยให้มีการพัฒนาผลิตภัณฑ์อย่างต่อเนื่อง
- เกิดความมั่นใจ เมื่อผลิตภัณฑ์เข้าสู่การใช้งานกับผู้ป่วย
รายการหัวข้อในการจัดทำ CSDT (อ้างอิงตาม AMDD, Annex 4) หัวข้อ ในการใส่ข้อมูลใน CSDT file ตั้งแต่การออกแบบ การผลิต การทดสอบ การใช้งาน ข้อมูลด้านคลินิก รวมไปถึงการทิ้งทำลาย ผลิตภัณฑ์ เรียกได้ว่าครบถ้วนตลอดวงจรของผลิตภัณฑ์เครื่องมือแพทย์
CSDT- Common Submission Dossier Template
หัวข้อใน CSDT ตามรายการข้างล่างนี้ นำมาจาก AMDD, Anex 4 หากผู้ผลิตต้องการยื่นขอรับรอง จากหน่วยงาน อย. กองควบคุมเครื่องมือแพทย์ ควรศึกษาและปฏิบัติตามแนวทางที่ อย. กำหนด จะชัดเจนและง่ายต่อการจัดทำ
The CSDT is organized into the following main sections:
1. ข้อมูลทั่วไปของผู้ผลิต Administrative Data: Introduction /Scope
-
- ชื่อผู้ยื่นหรือผู้ผลิต Applicant information
- รายละเอียดเบื้องต้นของผลิตภัณฑ์เครื่องมือแพทย์ (ชื่อสามัญ, ระดับความเสี่ยงที่กำหนดใน AMDD, วัตถุประสงค์การใช้, และอื่นๆ)
- ประเภทการยื่น Registration typeข้อมูลผู้ติดต่อ (Regulatory authority contact information)
2. บทสรุปผู้บริหาร (Executive Summary) :
-
- ภาพรวมขององค์กร ผู้ผลิต ประวัติความเป็นมา แบบย่อ
- ภาพรวมโดยย่อของอุปกรณ์หรือผลิตภัณฑ์ การใช้งานที่ต้องการและข้อมูลสนับสนุนที่สำคัญ เช่น นวัตกรรม มาตรฐาน
- ประวัติการวางจำหน่าย ประเทศที่รับอนุญาตวางจำหน่าย
- การเกิดเหตุข้อร้องเรียน การรายงานความไม่พึงประสงค์และ การปฏิบัติการแก้ไข
3. ข้อมูลหลักการสำคัญด้านความปลอดภัยและประสิทธิภาพ (Essential Principles -EP (ภาคผนวกที่ 1)
-
- การประเมินความปลอดภัยและประสิทธิภาพโดยต้องแสดงวิธีการ ความสอดคล้องในแต่ละหัวข้อ โดยอ้างอิงถึงมาตรฐานสากลเป็นหลัก กฎระเบียบข้อบังคับที่เกี่ยวข้อง การทดสอบ ข้อมูลด้านคลินิก (Clinical Data)
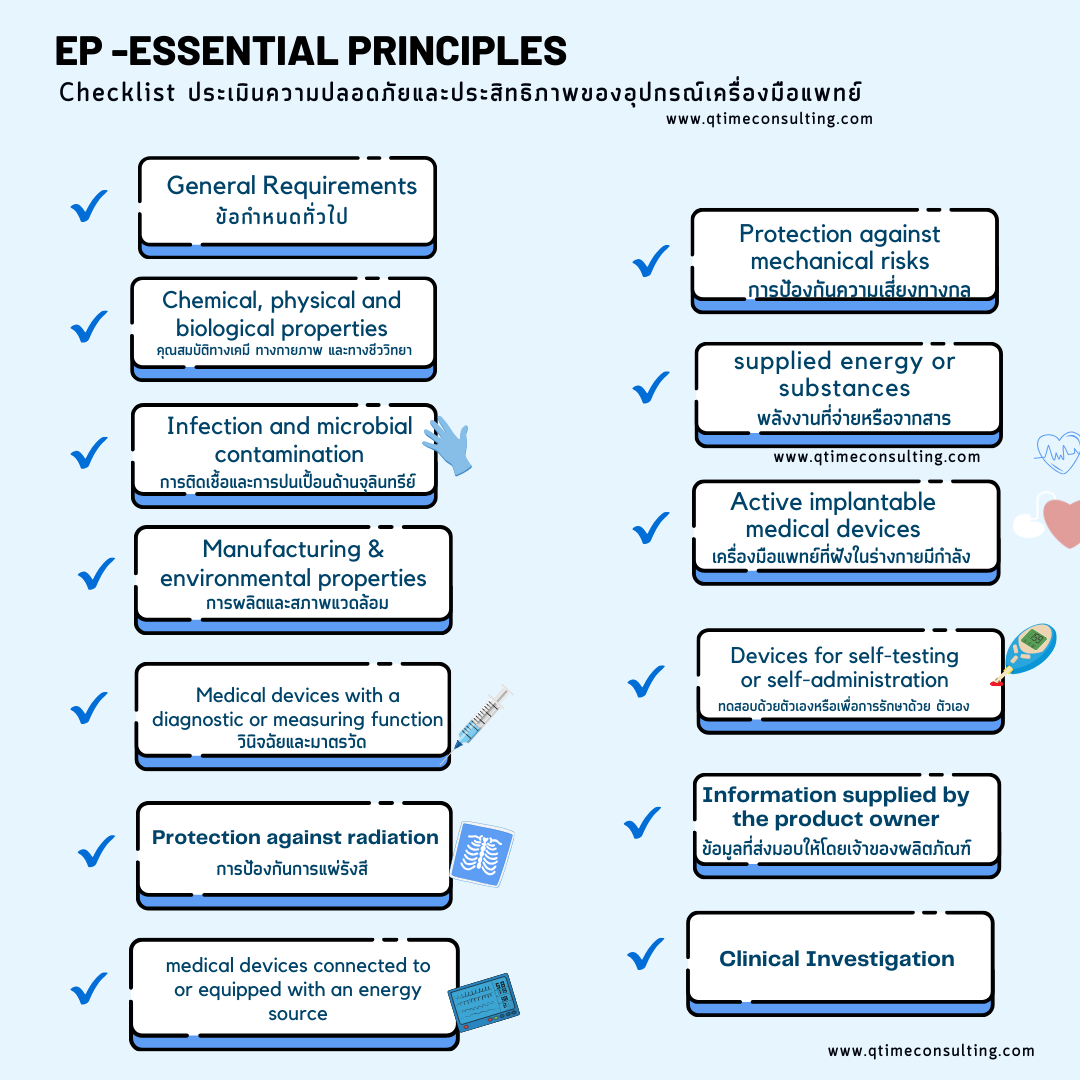
EP-Essential Principle ระบุอยู่ใน Annex I AMDD แบ่งหัวข้อที่ต้องประเมินแสดงข้อมูลเป็น 19 หัวข้อ
1) หลักการทั่วไป และการบริหารความเสี่ยง (General Principles / Risk Management) : การพยายามลดความเสี่ยงของอุปกรณ์การแพทย์ ตั้งแต่กระบวนการออกและพัฒนาผลิตภัณฑ์
2) การวิเคราะห์ประโยชน์และความเสี่ยงที่ต้องเตรียมข้อมูลทางด้านคลินิก (Clinical Benefit and Risk/Benefit Analysis)
3) บรรลุประสิทธิภาพและความปลอดภัยตามวัตถุประสงค์
4) การออกแบบและโครงสร้าง ผลิตภัณฑ์
5) ลักษณะและสมรรถนะต้องคงอยู่ระหว่างการขนส่งและการจัดเก็บ
6) การเปรียบเทียบระหว่างประโยชน์และความเสี่ยงหรือผลข้างเคียงไม่พึงประสงค์
7) การแสดงข้อมูลหลักฐานด้านคลินิกข้อมูลทางการแพทย์
8) คุณสมบัติและข้อกำหนดด้านเคมี กายภาพและจุลินทรีย์ (Chemical, Physical and Biological properties)
9) การปนเปื้อนด้านจุลินทรีย์และติดเชื้อ (Infection and microbial contamination)
10) การผลิตและคุณสมบัติด้านสภาพแวดล้อม (Manufacturing and environmental properties)
11) เครื่องมือแพทย์ที่มีวัตถุประสงค์เพื่อวินิจฉัยหรือมาตรวัด
12) การป้องกันการแผ่รังสี (Protection against radiation)
13) ข้อกำหนดสำหรับเครื่องมือแพทย์ที่เชื่อมต่อกับ หรือประกอบอยู่กับแหล่งหลังงาน (Requirements for medical devices connected to or equipped with an energy source)
14) การป้องกันความเสี่ยงทางกล (Protection against mechanical risks )
15) การป้องกันความเสี่ยงที่มีต่อผู้ป่วยจากพลังงานที่จ่ายหรือจากสาร (Protection against the risks posed to the patient by supplied energy or substances)
16) เครื่องมือแพทย์ฝันในร่างกายมีกำลัง หรือมีไฟฟ้า (Active implantable medical devices)
17) การป้องกันความเสี่ยงต่อผู้ป่วยสำหรับเครื่องมือแพทย์เพื่อทดสอบด้วยตัวเองหรือเพื่อการรักษาด้วย ตัวเอง(Protection against the risks posed to the patient for devices for self-testing or self-administration)
18) ข้อมูลที่ส่งมอบให้โดยเจ้าของผลิตภัณฑ์ (Information supplied by the product owner )
19) การวิจัยทางคลินิก (Clinical Investigation)
4. รายละเอียดผลิตภัณฑ์ Device Description:
-
- รายละเอียดที่ครอบคลุมเกี่ยวกับ คุณสมบัติ คุณลักษณะทางกายภาพ ทางด้านประสิทธิภาพ specification
- การออกแบบ วัสดุ ส่วนประกอบ วัตถุดิบ ฟังก์ชั่น
5. บทสรุปของการออกแบบ การทดสอบและการทวนสอบความถูกต้องของผลิตภัณฑ์
(Summary of Design Verification and Validation)
-
- การแสดงหลักฐานการทดสอบ ตรวจสอบ หรือ มาตรฐาน เพื่อยืนยันประสิทธิภาพและความปลอดภัย เช่นเลือกใช้วัตถุดิบ Pharma grade การทดสอบด้านกายภาพ การทดสอบด้านจุลินทรีย์ Evidence
- การตรวจรับรองความถูกต้อง (Validation) จากการประเมินข้อมูลด้านคลินิก การทดลองด้านคลินิกในผู้ป่วย ตามวัตถุประสงค์ที่ต้องการ
6. Preclinical and Clinical Data
-
- Non-clinical data (e.g., laboratory testing, animal studies)
- Clinical data (Clinical Evaluation, clinical trials, post-market surveillance)
7. ฉลากและข้อมูลสำหรับผู้ใช้:
-
- ข้อมูล ฉลากบนบรรจุภัณฑ์ Information provided on the device's label and packaging
- คู่มือการใช้งาน หรือ ข้อบ่งชี้การใช้ เช่น User Manual, IFU -Instructions for use, คำเตือน (warnings), ข้อควรระมัดระวัง,
8. การวิเคราะห์ความเสี่ยง Risk Analysis:
-
- การบ่งชี้และประเมินโอกาสเกิดอันตรายหรือความเสี่ยง
- การกำหนดมาตรการควบคุมที่เหมาะสม การสรุปผลภาพรวมความเสี่ยง
9. ข้อมูลผู้ผลิต Manufacturer Information:
-
- ขั้นตอนการผลิต
- ระบบมาตรฐานคุณภาพที่ผ่านการรับรอง
- มาตรฐานหรือกฎหมายที่เกี่ยวข้อง
- จำนวนสถานที่ผลิตหรือกิจกรรมที่ดำเนินการที่เกี่ยวข้อง
จากรายการข้างต้น หน่วยงานกำกับดูแลแต่ละประเทศอาจจะมีข้อกำหนดเพิ่มเติม ผู้ผลิตที่ต้องนำเข้าจำหน่ายจำเป็นต้องตรวจสอบสอบก่อน ยื่น CSDT และรวมถึง ขึ้นอยู่กับระดับความเสี่ยง (Risk Classification) ของอุปกรณ์เครื่องมือแพทย์
เทคนิคการจัดทำ CSDT file

มีเทคนิคที่สำคัญที่ผู้ยื่นต้องตรวจสอบและมั่นใจก่อนยื่น คือ
-
- แฟ้ม CSDT มีความสมบูรณ์และถูกต้องแม่นยำ มั่นใจว่าข้อมูลในแต่ละส่วน หรือ section มีความถูกต้อง สอดคล้องกับกฎระเบียบ มาตรฐานโดยเฉพาะมาตรฐานหลักของผลิตภัณฑ์
- มีความชัดเจนและรัดกุม ควรจะนำเสนอข้อมูลผลิตภัณฑ์ในลักษณะที่ชัดเจน สอบกลับได้
- การอ้างอิงและมีการเชื่อมโยงที่ต้องสอดคล้องกัน ในแต่ละ section ทั้งนี้ง่ายต่อการจัดทำข้อมูลและง่ายต่อการตรวจสอบจากหน่วยงานหรือผู้เชี่ยวชาญ
- เอกสารที่อ้างอิงหรือสนับสนุนข้อมูล ต้องจัดเตรียมแนบท้ายหรือภาคผนวก ตามความจำเป็นและเหมาะสม
- ปฏิบัติตามกฎระเบียบ AMDD ตรวจสอบให้แน่ใจอีกครั้งว่า CSDT สอดคล้องกับหลักการสำคัญของ EP-Essentail Principle และ AMDD
สรุปความสัมพันธ์ระหว่าง AMDD และ CSDT
-
- CSDT เป็นเครื่องมือที่เป็นรูปธรรม หรือผลลัพธ์ที่สำคัญแสดงถึงความสอดคล้อง และการปฏิบัติตามข้อกำหนด กฎหมาย AMDD
- เมื่อใช้ CSDT ผู้ผลิตหรือเจ้าของผลิตภัณฑ์ (Product Owner) มั่นใจได้ว่าข้อมูลที่ส่งมานั้นตรงตามกฎระเบียบที่ระบุไว้ใน AMDD
- CSDT ส่งเสริมการทบทวนกฎระเบียบที่มีประสิทธิภาพและการเข้าสู่ตลาดที่รวดเร็วยิ่งขึ้นสำหรับอุปกรณ์ทางการแพทย์ เพราะเป็นไปตามข้อกำหนดประเทศสมาชิก
- โดยสรุป AMDD กำหนดกรอบการกำกับดูแลสำหรับอุปกรณ์การแพทย์ในอาเซียน ในขณะที่ CSDT เป็นเครื่องมือที่เป็นรูปธรรม ตรวจสอบได้จริง สำหรับผู้ผลิตในการปฏิบัติตามกฎระเบียบและเข้าถึงตลาดในภูมิภาค
- Note ** ในกรณียื่นกับหน่วยงานกำกับดูแล โดยเฉพาะ อย. ผู้จัดทำ CSDT ต้องศึกษาและปฏิบัติตามแนวทางที่ อย.กำหนดอย่างละเอียด
Our Services :-
- 1. AMDD /CSDT training & Consulting
- 2. บริการจัดทำแฟ้ม CSDT
- 3. Clinical Evaluation Report
- 4. การจัดทำรายงานการทดสอบ
แหล่งข้อมูลอ้างอิง

