
Risk Management for IEC60601-1
ความเสี่ยงของเครื่องมือแพทย์ที่สำคัญหนึ่งคือ แหล่งอันตรายด้านไฟฟ้า (Electrical Hazard) ซึ่งมาจากเครื่องมือแพทย์ที่มีไฟฟ้าเป็นกำลัง หรือ Active Medical Device ตัวอย่างเครื่องมือแพทย์ไฟฟ้า เช่น เครื่องติดตามสัญญาณชีพ (Patient Monitor) ,
Dental Unit Chair, Operating table, Infant incubator เป็นต้น โดยเครื่องมือแพทย์ในกลุ่มนี้ต้องบริหารความเสี่ยงตามแนวทาง Guidelines ISO14971 ตลอดวงจรชีวิตของผลิตภัณฑ์ และสอดคล้องตามมาตรฐาน IEC 60601-1 ด้วยเช่นกัน
- IEC60601-1Medical electrical equipment, General requirements for safety
มาตรฐานเครื่องมือแพทย์ไฟฟ้า หรือ มาตรฐานผลิตภัณฑ์อุตสาหกรรม บริภัณฑ์ไฟฟ้าทางการแพทย์ เล่ม 1: ข้อกำหนดทั่วไปด้านความปลอดภัยและสมรรถนะที่สำคัญ (อ้างอิง:มอก.2629 เล่ม 1-2557) เริ่มประกาศใช้ ปี 1997 และมีการปรับแก้ไข (Update) โดยมาตรฐานครอบคลุม ด้านความปลอดภัยพื้นฐาน (Basic Safety) และสมรรถนะที่สำคัญ (Essential Performance) เครื่องมือแพทย์หรืออุปกรณ์ทางการแพทย์ทั่วไป IEC60601-1 ไม่รวมถึงผลิตภัณฑ์ไฟฟ้าทางการแพทย์ กลุ่ม IVD (In-Vitro diagnostic Medical Device) หรือกลุ่มวินิจฉัยโรค, กลุ่มเครื่องมือแพทย์ฝังในร่างกาย (Implantable medical device ) และ กลุ่มผลิตภัณฑ์ระบบท่อแก๊สทางการแพทย์ (Medical Gas Pipeline System)
- IEC 60601-1 จัดมาตรฐาน แบ่งเป็น Collateral and Particular
Collateral Standards มาตรฐานข้อกำหนดด้านความปลอดภัยพื้นฐานและประสิทธิภาพที่สำคัญของเครื่องมือแพทย์ เช่น IEC6060-1-2, IEC60601-1-3, IEC60601-1-6
Particular standards มาตรฐานเฉพาะของผลิตภัณฑ์หรืออุปกรณ์ไฟฟ้าทางการแพทย์นั้นๆ โดยยังคงเน้นด้านความปลอดภัยและประสิทธิภาพหรือสรรถนะ เฉพาะของอุปกรณ์หรือเครื่องมือแพทย์นั้นเช่น เครื่องมือแพทย์ที่ใช้แสงเลเซอร์ในการรักษา, เครื่องมือแพทย์มีฟังก์ชั่นปรับระดับสำหรับการรักษาผู้ป่วย, มาตรฐานกลุ่ม Particular standards เช่น IEC60601-2-4:Safety of cardiac defibrillators , IEC60601-2-2:High frequency surgical equipment and high frequency surgical accessories เป็นต้น

- Risk Management and IEC60601-1
IEC60601-1 เป็นมาตรฐาน Essential Performance หรือมาตรฐานใช้ทดสอบความปลอดภัยด้านไฟฟ้าเพื่อยืนยันความปลอดภัยและประสิทธิภาพของเครื่องมือแพทย์ที่มีไฟฟ้าเป็นกำลัง ซึ่งส่วนหนึ่งของมาตรฐาน IEC 60601-1 ต้องการให้ผู้ผลิตต้องจัดทำบริหารความเสี่ยงตั้งแต่การออกแบบและพัฒนาผลิตภัณฑ์ จนถึงการใช้งานเครื่องมือแพทย์ โดยใช้แนวทาง ISO 14971 Risk Management for Medical Device หรือเรียกได้ว่าตลอดวงจรอายุผลิตภัณฑ์เครื่องมือแพทย์ที่มีไฟฟ้า (Active Medical Device)
- ขั้นตอนการจัดทำ Risk Management ตาม IEC 60601-1
อ้างอิงตามแนวทางหรือ Guideline ISO 14971 Risk Management for Medical Device มีขั้นตอนดำเนินการ
- Risk Management Plan จัดทำแผนการบริหารความเสี่ยง
เมื่อผู้ผลิตได้กำหนดรายละเอียดผลิตภัณฑ์ (Device Description) โดยเฉพาะในขณะออกแบบ ผู้ผลิตควรต้องวางแผนบริหารความเสี่ยงด้วย เนื่องจากจะทำให้มองเห็นอันตรายหรือความเสี่ยงตั้งแต่การออกแบบและกำหนดวิธีลด ควบคุมความเสี่ยงไว้ตั้งแต่ขั้นตอนแรกเลย แผนบริหารความเสี่ยงประกอบด้วย
- ขอบเขต และกระบวนการ
- ทีมบริหารความเสี่ยง
- กำหนดกระบวนการ วิธีการบริหารความเสี่ยง
- การวิเคราะห์ความเสี่ยง
- เกณฑ์การประเมิน และยอมรับความเสี่ยง
- แผนการควบคุมความเสี่ยง
- สรุปผลภาพรวมความเสี่ยง
- Risk Analysis การวิเคราะห์ความเสี่ยง
แนวทางการวิเคราะห์ความเสี่ยงสำหรับเครื่องมือแพทย์ที่ใช้ไฟฟ้าเป็นกำลัง มีประเด็นที่ต้องพิจารณาคือแหล่งที่มาของอันตรายที่มาจากไฟฟ้า ไม่ว่าจะเป็นสภาวะการใช้งานแบบปรกติ ถูกต้องตามเงื่อนไขและวิธีการใช้ที่กำหนด และวิเคราะห์ในสถานการณ์ไม่ปรกติเช่น ผิดขั้นตอน ใช้ไม่ถูกวิธี ผู้ใช้ไม่มีความรู้ความเชี่ยวชาญในการใช้ อุปกรณ์ วัสดุชิ้นส่วนไฟฟ้าทำงานผิดปรกติ หรือ มีความเสื่อมจากการที่ใช้งานที่ยาวนาน ตัวอย่างแหล่งอันตราย (Hazard) ของเครื่องมือแพทย์ไฟฟ้า เช่น Electric energy

นอกจากผู้ผลิตต้องวิเคราะห์ความเสี่ยงจากแหล่งอันตรายด้านไฟฟ้าอย่างครบทุกด้านแล้ว แหล่งอันตรายในด้านอื่นๆ ก็ต้องวิเคราะห์ด้วยเช่นกัน เช่น ด้านความเข้ากันได้ทางชีวภาพ (Biocompatibility) ด้านชีวภาพหรือจุลินทรีย์ (Biological) ทั้งนี้ขึ้นอยู่กับลักษณะการใช้งานและเงื่อนไขเครื่องมือแพทย์ เช่นต้องสัมผัสกับผู้ป่วยในระหว่างการรักษา
- Risk Evaluation การประเมินความเสี่ยง
การประเมินระดับความรุนแรงและโอกาสเกิดความเสี่ยง ผู้ผลิตต้องกำหนดเกณฑ์การยอมรับความเสี่ยงนั้น ว่ามีความเสี่ยงระดับ High-Medium-Low เพื่อชี้วัดว่า ผลิตภัณฑ์ต้องค้นหามาตรการลดและควบคุมความเสี่ยงอีกหรือไม่
- Risk Controls การควบคุมความเสี่ยง
- การกำหนดวิธีการลด หรือควบคุมความเสี่ยง ในส่วนของอุปกรณ์และผลิตภัณฑ์เครื่องมือแพทย์ที่มีกำลัง โดยใช้วิธีการใช้อุปกรณ์ทางไฟฟ้าที่ได้มาตรฐาน ตั้งแต่กระบวนการออกแบบมากำจัดหรือลดความเสี่ยง และสุดท้ายต้องใช้สัญลักษณ์ที่แสดงถึงความปลอดภัย (Safety Symbol) สื่อสารให้ผู้ใช้ได้รับรู้ และปฏิบัติอย่างถูกต้อง
- ตัวอย่าง Electrical Safety Symbol

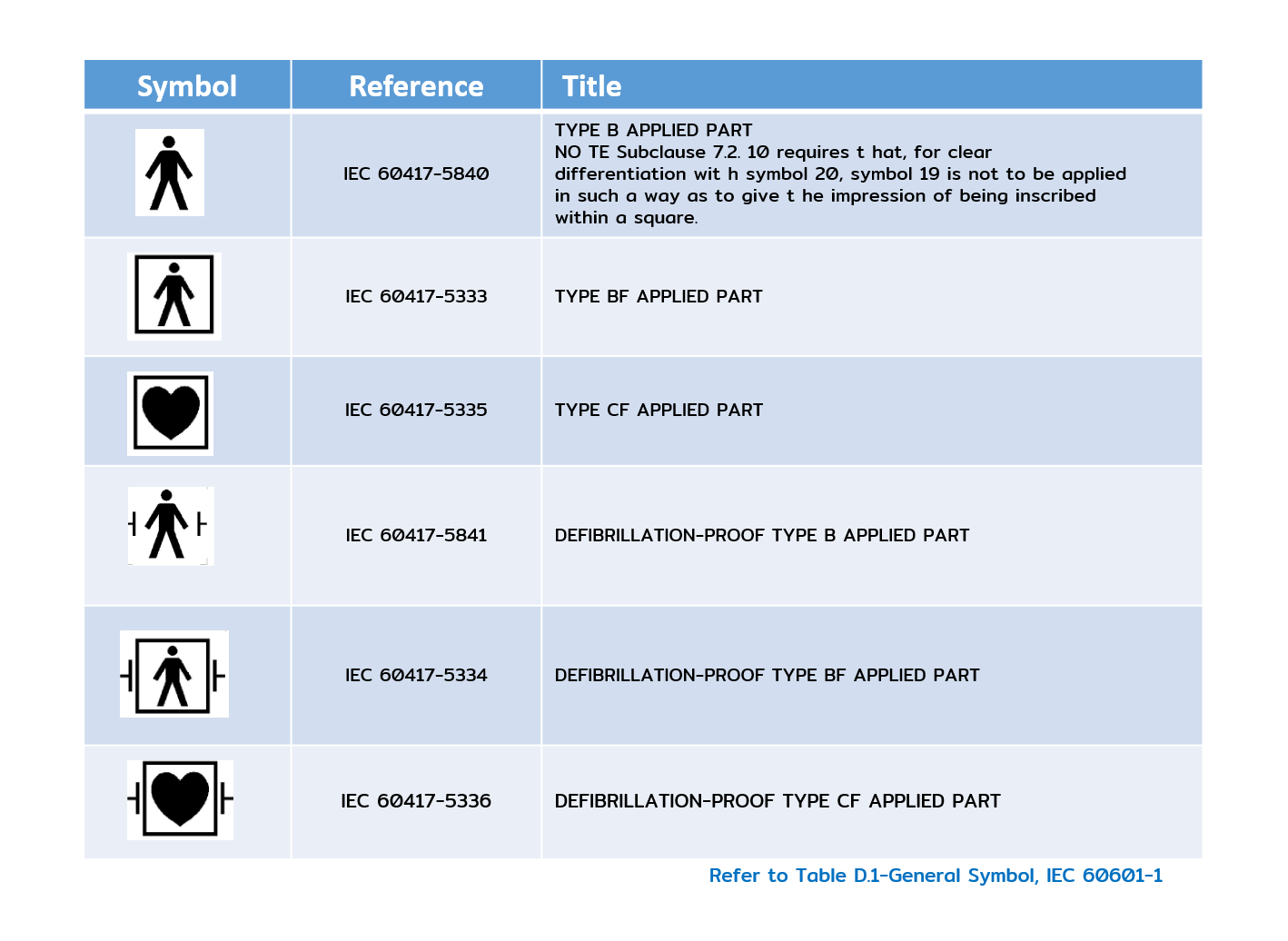
- Overall Risk Responsibility ภาพรวมความเสี่ยงและความรับผิดชอบ
- จากการสรุปความเสี่ยงทั้งหมดที่ผู้ผลิตได้วิเคราะห์ ประเมินและกำหนดมาตรการควบคุมแล้ว ต้องพิจารณาภาพรวมความเสี่ยงที่หลงเหลือ เป็นความเสี่ยงที่ยอมรับได้หรือไม่ หากยังเป็นความเสี่ยงที่ยอมรับไม่ได้ หรือยังคงมีความเสี่ยงสูง ผู้ผลิตควรต้องพิจารณา ค้นหาวิธีลดความเสี่ยงนั้นก่อน รวมถึงความเสี่ยงนี้อาจจะส่งผลกระทบต่อการทดสอบผลิตภัณฑ์ตาม IEC 60601-1 คือ ไม่ผ่านการทดสอบในหัวข้อที่เกี่ยวข้องนี้ด้วยเช่นกัน
- Risk Management Report การจัดทำรายงานความเสี่ยง
- เมื่อวิเคราะห์ ประเมินและกำหนดมาตรการควบคุมความเสี่ยงได้ครบถ้วนตลอดวงจรผลิตภัณฑ์ โดยเฉพาะการใช้งานแล้ว ต้องนำข้อมูลและรายละเอียดผลิตภัณฑ์ มาจัดทำรายงานบริหารความเสี่ยง
- Production and Post-production Risks การติดตามข้อมูลการผลิตและหลังการผลิต
ผลิตภัณฑ์ที่ปล่อยเข้าสู่การใช้งานแล้ว ผู้ผลิตต้องติดตามตรวจสอบด้านความปลอดภัยและประสิทธิภาพหรือสมรรถนะของเครื่องมือแพทย์ ว่ามีความปลอดภัยตามที่ได้ตั้งใจ
การจัดการความเสี่ยงสำหรับผลิตภัณฑ์ มีความสำคัญอย่างยิ่ง นอกจากเป็นส่วนหนึ่งของมาตรฐาน IEC 60601-1 แล้ว ผู้ผลิตยังมั่นใจได้ว่าผลิตภัณฑ์เครื่องมือแพทย์มีความปลอดภัย โดยเฉพาะด้านไฟฟ้า และยังมั่นใจในประสิทธิภาพและสมรรถนะของผลิตภัณฑ์ ที่มีต่อการรักษา บำบัด หรือบรรเทาต่อผู้ป่วยได้ตามวัตถุประสงค์ที่ตั้งใจ
การบริการของ คิวไทม์ คอนซัลติ้ง เซอร์วิส
- แนะนำข้อกำหนดแนวทางการวิเคราะห์และการจัดการความเสี่ยง ผลิตภัณฑ์เครื่องมือแพทย์ที่มีไฟฟ้าเป็นกำลัง ตามมาตรฐาน IEC60601-1 และ ISO14971
- คิวไทม์ ให้บริการอบรม Risk Management for Medical Device Training
บทความเกี่ยวกับ ISO14971 Risk Management for Medical Device
แหล่งข้อมูลอ้างอิง
IEC 60601-1: 3rd edition Medical electrical equipment Part 1 : General requirements for basic safety and essential performance
ISO 14971 : Medical devices - Application of risk management to medical devices
มอก.2629 เล่ม 1-2557 มาตรฐานผลิตภัณฑ์อุตสาหกรรมบริภัณฑ์ไฟฟ้าทางการแพทย์ เล่ม 1 : ข้อกำหนดทั่วไปด้านความปลอดภัยมูลฐาน

